
วันนี้มาเรียน SAT Chemistry กับเรื่อง Energy Change กันครับ การเปลี่ยนแปลงทางเคมีเสมอ เกิดจากมุมมองอันประกอบไปด้วย
- ระบบ (System) คือ สิ่งที่เราให้ความสนใจ และ
- สิ่งแวดล้อม (Surroundings) คือ สิ่งที่อยู่นอกเหนือขอบเขตที่เราสนใจ
ตัวอย่าง ในบทเรียน SAT Chemistry จะมีเรื่องการละลายของน้ำแข็ง (ระบบ คือ น้ำแข็ง และ สิ่งแวดล้อม คือ อากาศภายนอกหรือสิ่งอื่นที่ไม่ใช่น้ำแข็ง) ในวิชา SAT Chemistry เคมี ความรู้แขนงนี้ถูกต่อยอด ด้วยการนำหลักการทางความร้อนมาใช้พบว่า การเปลี่ยนแปลงทางเคมี โดยส่วนมากแล้ว จะทำให้เกิดการเปลี่ยนแปลงพลังงานตามมาเสมอ
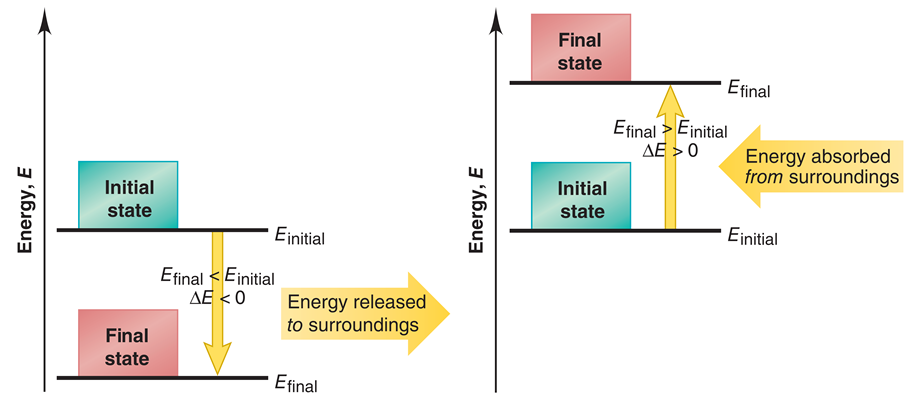
เมื่อติว SAT Chemistry เราจะต้องเรียนรู้เรื่องการเปลี่ยนแปลงพลังงาน ที่เกิดขึ้นได้ทั้งหมด 2 แบบ ได้แก่
- การคายพลังงาน (ภาพด้านซ้ายมือ) เกิดขึ้นเมื่อระบบปล่อยพลังงานออกมาสู่สิ่งแวดล้อม ทำให้พลังงานภายในระบบลดลง ส่งผลให้พลังงานของระบบ ณ จุดสุดท้าย มีค่าน้อยกว่า พลังงานของระบบ ณ จุดเริ่มต้น หรือ เขียนในรูปสูตรคำนวณได้ว่า Efinal – Einitial = ∆E < 0 (ติดลบ)
ปฏิกิริยาเคมีที่มีการคายความร้อน จะเรียกว่า Exothermic reaction ตัวอย่าง การเผาไหม้เชื้อเพลิง, การต้มน้ำให้เดือด
- การดูดพลังงาน (ภาพด้านขวามือ) เกิดขึ้นเมื่อระบบได้รับพลังงานจากสิ่งแวดล้อม ทำให้พลังงานภายในระบบเพิ่มขึ้น ส่งผลให้พลังงานของระบบ ณ จุดสุดท้าย มีค่ามากกว่า พลังงานของระบบ ณ จุดเริ่มต้น หรือ เขียนในรูปสูตรคำนวณได้ว่า Efinal – Einitial = ∆E > 0 (เป็นบวก)
ปฏิกิริยาเคมีที่มีการดูดความร้อน จะเรียกว่า Endothermic reaction ตัวอย่าง การละลายน้ำตาล, การแช่ไอศกรีมในตู้เย็น
ข้อเสนอแนะ ∆E = 0 หมายความว่า ระบบไม่มีการเปลี่ยนแปลงพลังงาน
หลายคนที่อ่านมาถึงตรงนี้จะรู้สึกว่า ทำไมเนื้อหาง่ายมากแบบนี้จึงอยู่ในบทเรียน SAT Chemistry ดังนั้นจึงขอตั้งคำถามเพื่อวัดความเข้าใจ
เช่น เด็กโดนน้ำร้อนลวก เป็นการเปลี่ยนแปลงแบบดูดหรือคายความร้อน ? คำตอบที่ถูกต้อง คือ โจทย์ให้ข้อมูลไม่เพียงพอ
- ถ้าสนใจเด็กเป็นหลัก แสดงว่า เด็ก คือ ระบบ และ น้ำร้อน คือ สิ่งแวดล้อม
เด็กได้รับความร้อนจากน้ำ แสดงว่าระบบได้รับความร้อน จึงเป็นกลไกการดูดความร้อน
- ถ้าสนใจน้ำร้อนเป็นหลัก แสดงว่า น้ำร้อน คือ ระบบ และ เด็ก คือ สิ่งแวดล้อม
เด็กได้รับความร้อนจากน้ำ แสดงว่าสิ่งแวดล้อมได้รับความร้อนจากระบบ จึงเป็นกลไกการคายความร้อน
อย่างไรก็ตาม คำถามในข้อสอบวิชาเคมีย่อมสนใจ สารเคมีเป็นหลัก ดังนั้น น้ำร้อน จึงเป็นระบบ ทำให้คำตอบที่ถูกต้องมากกว่า คือ
กลไกการคายความร้อน
นอกจากนี้ในข้อสอบและบทเรียน SAT Chemistry นิยมใช้แผนภาพประกอบ

จากภาพทางด้านบนเห็นชัดได้ว่า น้ำเป็นระบบ (System) โดยทั้งสองภาพแสดงการเปลี่ยนแปลงทางความร้อน อันได้แก่
- การตั้งน้ำร้อนทิ้งไว้ให้กลายเป็นน้ำอุ่นที่อุณหภูมิห้อง
กลไกทางความร้อน พบว่าเป็น กลไกการคายความร้อน
- การตั้งน้ำเย็นที่มีน้ำแข็งทิ้งไว้ให้กลายเป็นน้ำอุ่นที่อุณหภูมิห้อง
กลไกทางความร้อน พบว่าเป็น กลไกการดูดความร้อน
ข้อสรุป จำไว้ว่า “ระบบร้อนขึ้น คือ ดูด ส่วนระบบเย็นลง คือ คาย”
เพียงเท่านี้เนื้อหาเรียน SAT Chemistry เรื่อง Energy change ก็ไม่ใช่เนื้อหายากอีกต่อไป
ติดต่อสอบถามคอร์สการเรียน SAT ได้ที่เบอร์ 02-253-2533 หรือ 095-726-2666
หรือ LINE: @theplanner
